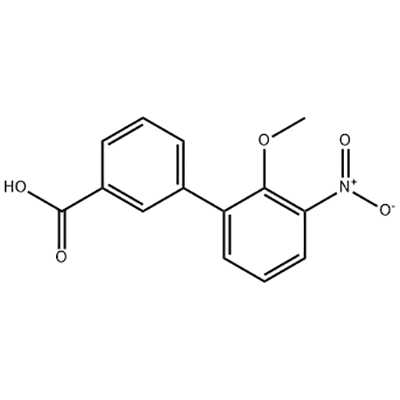
2′-Methoxy-3′-nitro-biphenyl-3-carboxylic အက်ဆစ်
2′-Methoxy-3′-nitro-biphenyl-3-carboxylic အက်ဆစ်
2'-Methoxy-3'-nitro-biphenyl-3-carboxylic acid ကို Eltrombopag ၏ အလယ်အလတ်အဖြစ် အသုံးပြုသည်။
ယူကေရှိ GlaxoSmithKline (GSK) မှတီထွင်ပြီး နောက်ပိုင်းတွင် ဆွစ်ဇာလန်ရှိ Novartis နှင့် ပူးပေါင်းထုတ်လုပ်သည့် Eltrombopag သည် ကမ္ဘာပေါ်တွင် ပထမဆုံးနှင့် တစ်ခုတည်းသော ခွင့်ပြုထားသော peptide မဟုတ်သော TPO receptor agonist သေးငယ်သောမော်လီကျူးဖြစ်သည်။Eltrombopag ကို US FDA မှ idiopathic thrombocytopenic purpura (ITP) ကုသမှုအတွက် 2008 တွင် အတည်ပြုခဲ့ပြီး 2014 ခုနှစ်တွင် ပြင်းထန်သော aplastic သွေးအားနည်းရောဂါ (AA) ကို ကုသရန်အတွက် အတည်ပြုခဲ့သည်။၎င်းသည် မကြာသေးမီနှစ်ပေါင်း 30 အတွင်း AA ကိုကုသရန်အတွက် US FDA မှခွင့်ပြုထားသောပထမဆုံးဆေးလည်းဖြစ်သည်။
2012 ခုနှစ် ဒီဇင်ဘာလတွင် US FDA မှ thrombocytopenia ကုသမှုအတွက် Eltrombopag ကို နာတာရှည် အသည်းရောင်အသားဝါ C (CHC) ရှိသော လူနာများတွင် ကုသရန် ခွင့်ပြုပေးသောကြောင့် အသည်းရောင်အသားဝါ C နည်းပါးသော လူနာများသည် အသည်းရောဂါများအတွက် interferon အခြေခံ စံကုထုံးကို စတင်ထိန်းသိမ်းနိုင်စေရန်။ဖေဖော်ဝါရီ 3,2014 တွင် GlaxoSmithKline သည် ပြင်းထန်သော ဓာတုဗေဒစာအုပ် aplastic သွေးအားနည်းရောဂါ (SAA) ကို အပြည့်အဝတုံ့ပြန်ခြင်းမရှိသော immunotherapy ကုသမှုကို အပြည့်အဝမတုံ့ပြန်သော လူနာများတွင် သွေးအားနည်းရောဂါကုသခြင်းအတွက် Eltrombopag ၏ အောင်မြင်သော ကုသဆေးအရည်အချင်းကို FDA က ခွင့်ပြုပေးလိုက်ကြောင်း ကြေညာခဲ့သည်။2015 ခုနှစ် ဩဂုတ်လ 24 ရက်နေ့တွင် US FDA မှ corticosteroids၊ immunoglobulins သို့မဟုတ် splenectomy ကိုမလုံလောက်သော နာတာရှည်ကိုယ်ခံအားသွန်ဘိုဆိုက်တိုပီနီးယား (ITP) ဖြင့် အရွယ်ရောက်ပြီးသူနှင့် အသက် 1 နှစ်နှင့်အထက် ကလေးများတွင် thrombocytopenia ကုသမှုအတွက် Eltrombopag ကို အတည်ပြုခဲ့သည်။ဇန်နဝါရီ 4၊ 2018 တွင် Eltrombopag သည် မူလကိုယ်ခံအားသွန်ဘိုဆိုက်တိုပီနီးယား (ITP) ကုသမှုအတွက် တရုတ်နိုင်ငံတွင် စာရင်းသွင်းရန် အတည်ပြုခဲ့သည်။



![Pentamethylene bis[1-(3,4-dimethoxybenzyl)-3,4-dihydro-6,7-dimethoxy-1H-isoquinoline-2-propionate]၊ Dixalate](http://cdn.globalso.com/jindunchem-med/image281-300x300.png)

![Casp ungin Acetate၊Caspofungin acetate၊ Cancidas;Caspofungin acetate [USAN:BAN:JAN];](http://cdn.globalso.com/jindunchem-med/fbe17385-300x300.jpg)